F. Javier Cabañes
Grupo de Micología Veterinaria, Departamento de Sanidad y Anatomía Animales, Facultad de Veterinaria, Universitat Autònoma de Barcelona, Bellaterra, España.
En la última guía publicada sobre el diagnóstico y el manejo de micosis raras en humanos causadas por hongos miceliares, se subraya la elevada resistencia a los antifúngicos que presentan algunas de las especies que las causan y se dan pautas para su tratamiento [Hoenigl et al. 2021]. En algunas ocasiones estos hongos tienen predilección por infectar gravemente a personas con enfermedades subyacentes, presentando una alta tasa de mortalidad.
Entre estos super hongos destaca la especie que produce la lomentosporiosis, Lomentospora prolificans (anteriormente Scedosporium prolificans) que es un hongo saprofito de suelos. La mayoría de casos descritos se citan en Australia y el suroeste de EE.UU. y en menor porcentaje en España, Alemania y Japón. No obstante, se desconocen en gran medida los datos de prevalencia e incidencia de esta micosis. Esta especie parece ser intrínsicamente resistente a la mayoría de los antifúngicos utilizados, mostrando valores de CMI elevados para anfotericina B, itraconazol, voriconazol, posaconazol, terbinafina, caspofungina, micafungina y anidulafungina. En esta guía se recomienda la terapia antifúngica combinada para el tratamiento de estas infecciones, en particular voriconazol y terbinafina, entre otros.
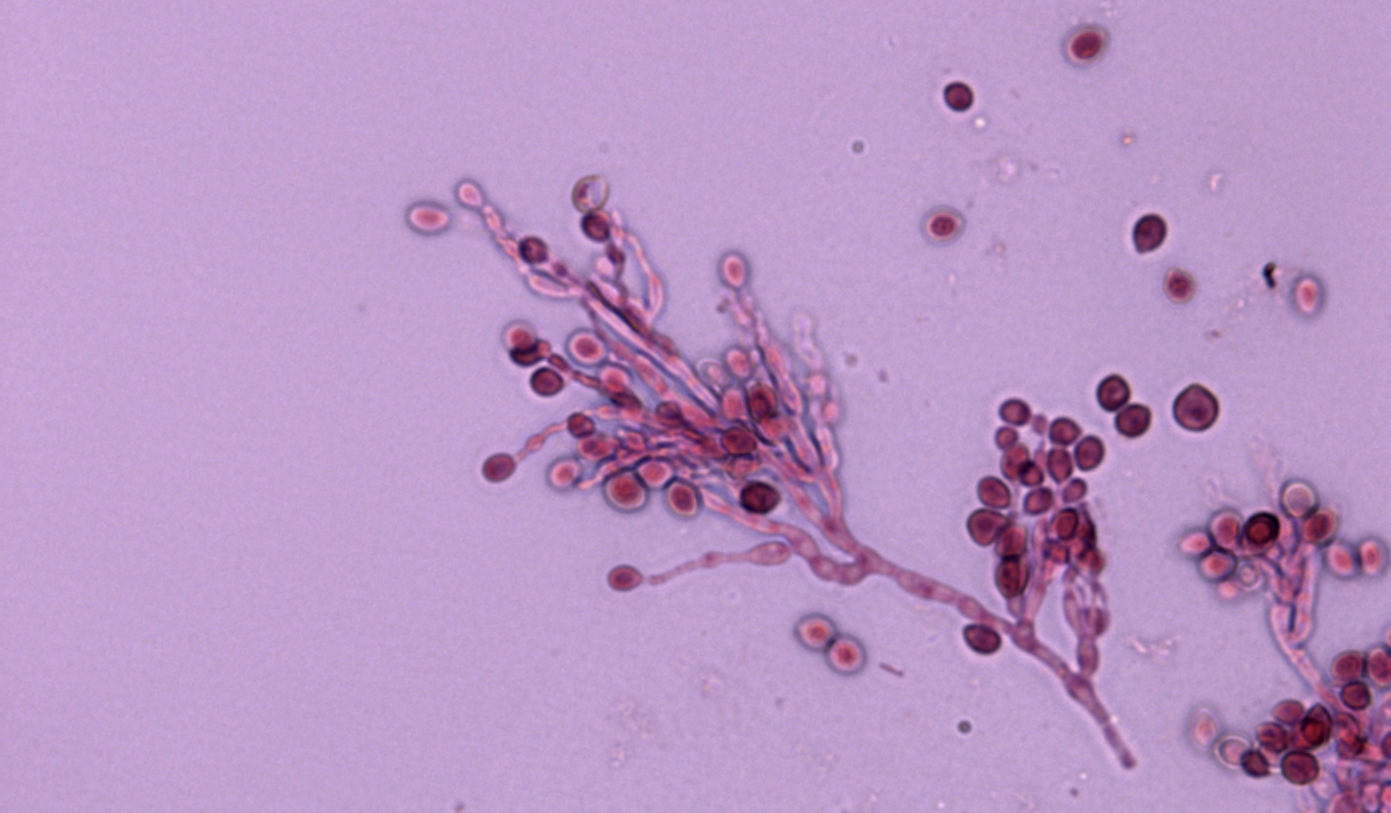
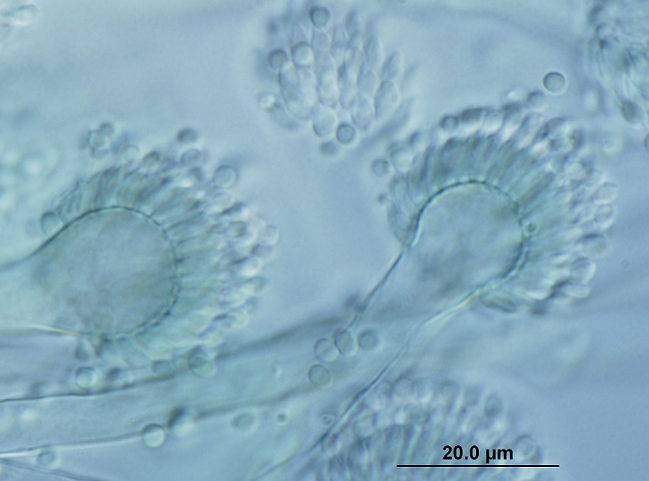
La identificación de L. prolificans se consigue mediante el examen macroscópico y microscópico de sus colonias. Éstas suelen ser negruzcas de aspecto húmedo y presentan unas características células conidiógenas anelídicas en forma de frasco que forman conidios obovoides. No obstante, la identificación debe confirmarse mediante la posterior secuenciación de la región ITS1-5.8S-ITS2 del rDNA.
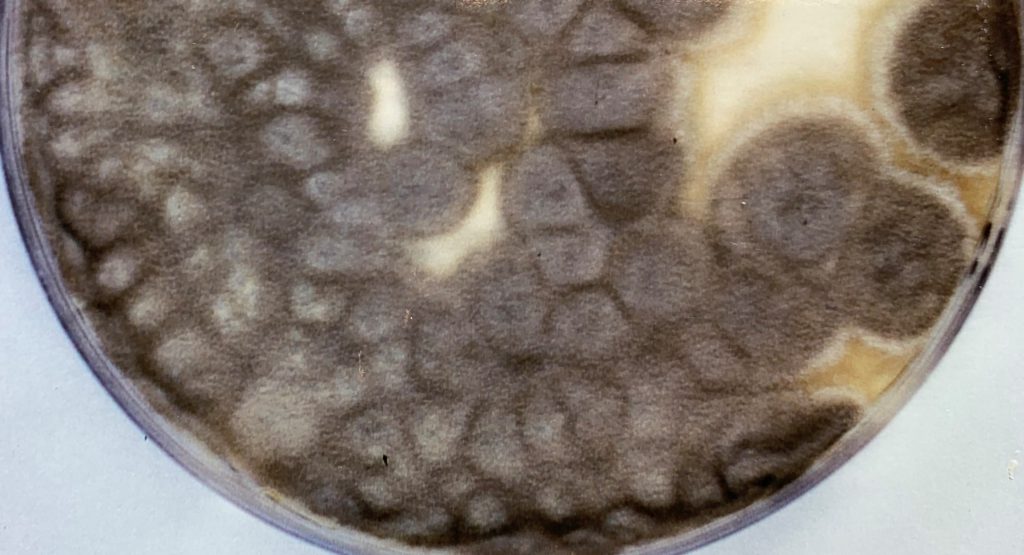
La identificación de L. prolificans se puede conseguir mediante la caracterización morfológica macroscópica y microscópica de los aislamientos. Las colonias suelen ser negruzcas de aspecto húmedo y presentan unas características células conidiógenas anelídicas en forma de frasco que forman conidios obovoides. No obstante, la identificación debe confirmarse mediante la posterior secuenciación de la región ITS1-5.8S-ITS2 del rDNA.
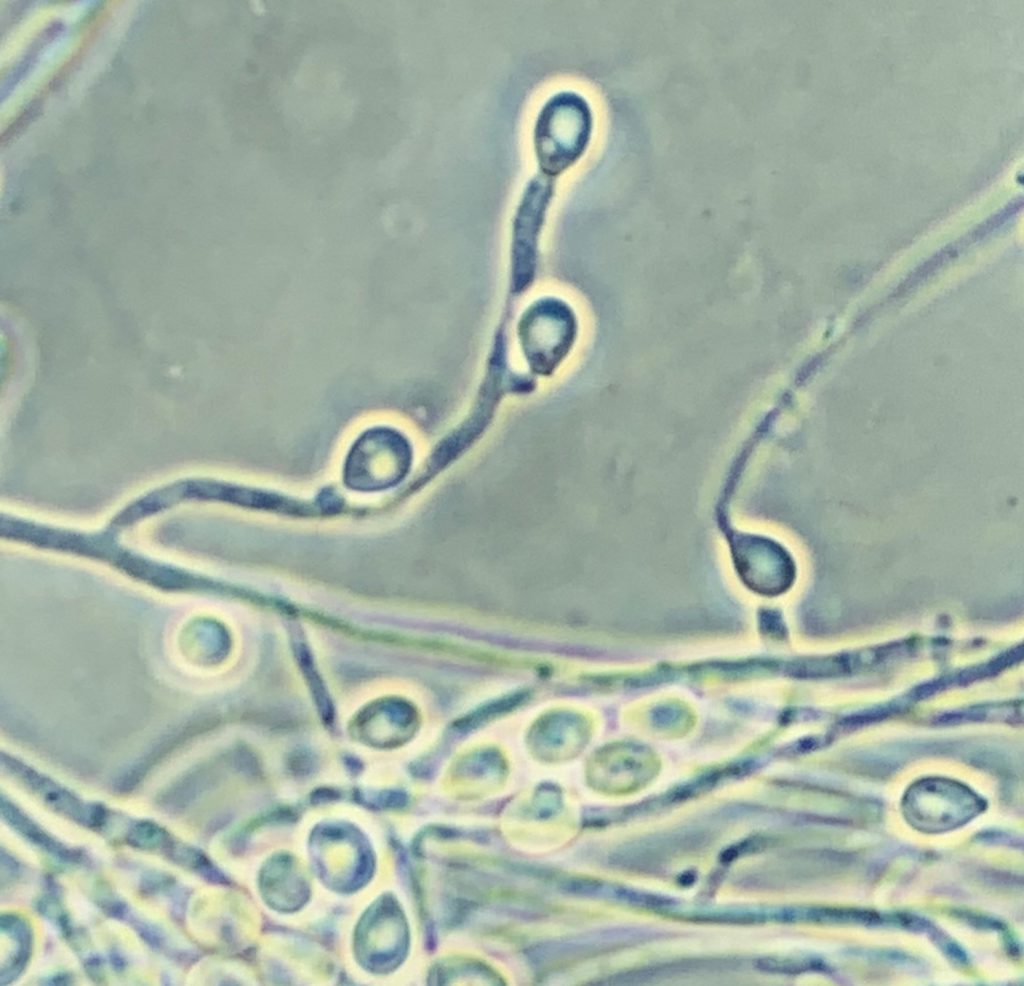
También hay que destacar las productoras de escedosporiosis, causadas por distintas especies del género Scedosporium y principalmente por algunas de las incluidas en el complejo Scedosporium apiospermum, como Scedosporium apiospermum sensu stricto y Scedosporium boydii. En el ámbito clínico, estas dos últimas son las más aisladas en todo el mundo. A diferencia de L. prolificans, pueden presentar dos formas de reproducción asexual (sinanamorfos tipo Scedosporium y tipo Graphium) con células conidiógenas no infladas, que forman mayoritariamente conidios obovoides o elipsoidales. Para confirmar su identificación a nivel de especie, se requiere la secuenciación tanto de los ITS como del gen de la β- tubulina.
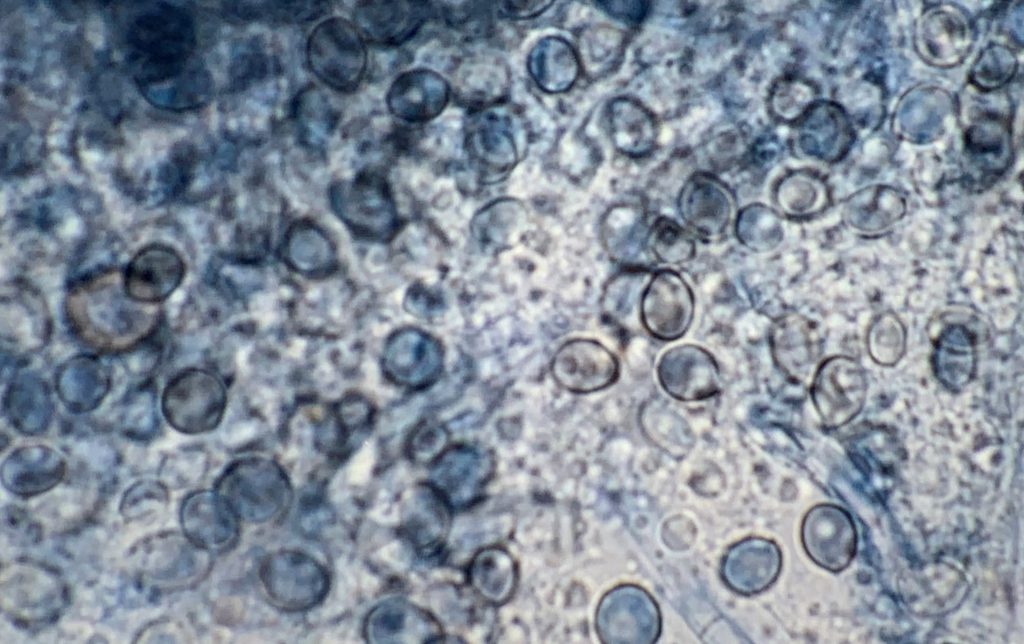
La mayoría de los casos se han registrado en EE.UU., Australia, Alemania, India, España y Japón. Estas especies presentan también valores altos de CMI para anfotericina B, isavuconazol, itraconazol y fluconazol. Los valores de CMI más bajos se obtienen para voriconazol, posaconazol y las equinocandinas. Estas directrices recomiendan principalmente el voriconazol para el tratamiento de estas micosis y el uso del desbridamiento quirúrgico, cuando sea aplicable.
En animales estas micosis son también muy raras. Los casos más frecuentemente publicados son los que afectan a perros, pero apenas se han descrito una veintena de ellos (búsqueda en Pubmed utilizando los siguientes descriptores: “Scedosporium” AND “dogs” y “Pseudallescheria” AND “dogs”; 28 de abril de 2021).
Las lomentosporiosis son las menos frecuentes y se han descrito exclusivamente casos de infecciones diseminadas en perros inmunodeprimidos, presentando mal pronóstico. De los pocos casos existentes, la mayoría se localizan también en Australia. Uno de estos casos afectó a un animal que estaba recibiendo un tratamiento farmacológico inmunosupresor para la anemia hemolítica inmunomediada que presentaba [Taylor et al. 2014]. La cepa de L. prolificans aislada fue resistente a todos los antifúngicos ensayados: anfotericina B, 5-fluorocitosina, itraconazol, fluconazol, voriconazol, posaconazol, caspofungina, micafungina y anidulafungina. A pesar de la interrupción de la medicación inmunosupresora y de una respuesta inicial al tratamiento con voriconazol y terbinafina, el perro desarrolló una enfermedad progresiva con signos neurológicos que hizo necesaria la eutanasia a los seis meses del diagnóstico.
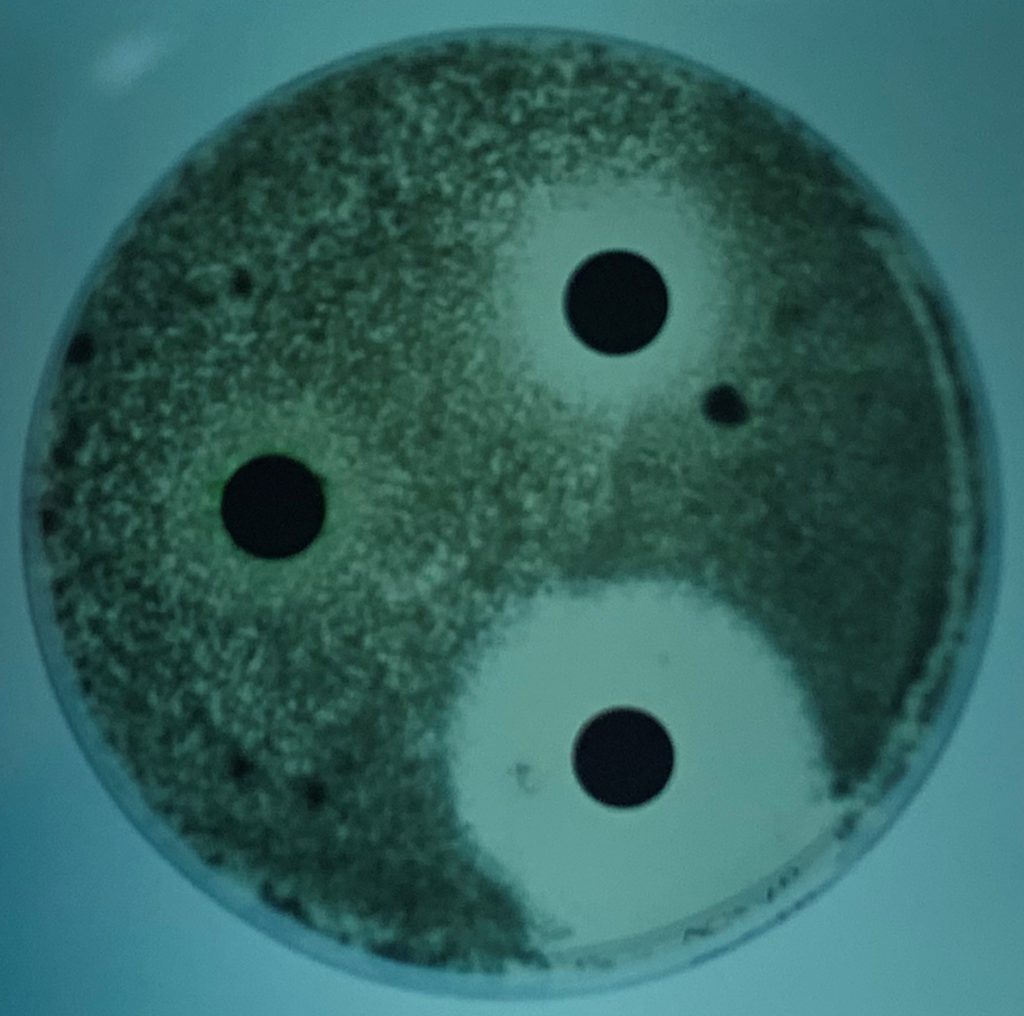
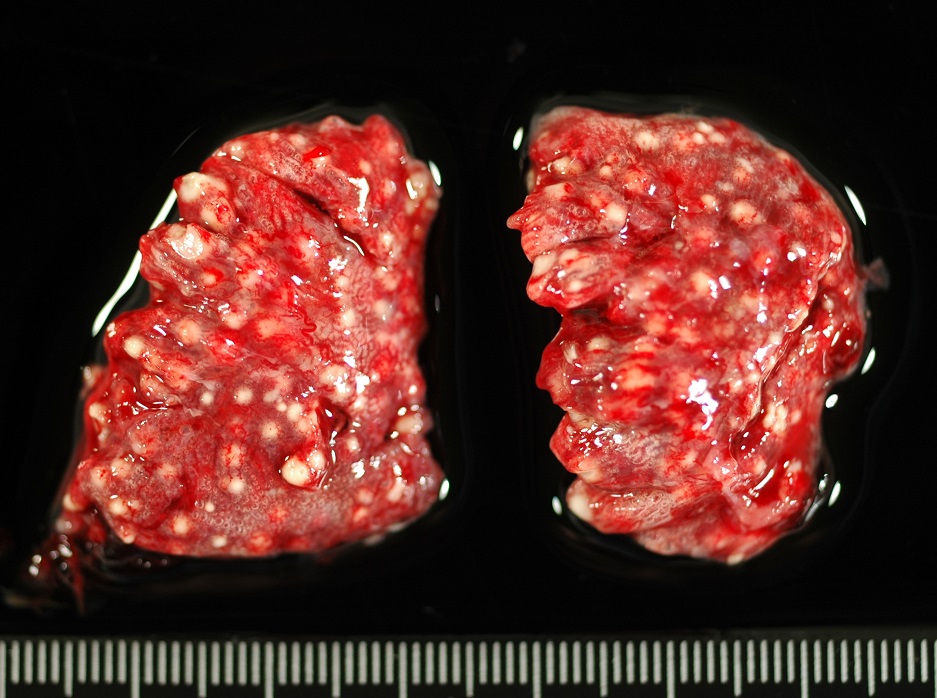
Aunque en las escedosporiosis en perros también incluyen infecciones diseminadas, son más frecuentes las infecciones localizadas, que afectan principalmente a la cavidad nasal, cavidad abdominal y a la córnea. Ya hace muchos años, en nuestro laboratorio tuvimos la oportunidad de describir, en colaboración con distintos especialistas de la Facultad de Veterinaria de la Universidad Autónoma de Barcelona, el primer caso de un granuloma fúngico en la cavidad nasal producido por S. apiospermum [Cabañes et al. 1998]. Los agentes etiológicos comúnmente aislados en este tipo de micosis suelen ser especies de Aspergillus, principalmente A. fumigatus [Cabañes, 2020]. A parte de aislar el agente etiológico de las muestras, se pudo evidenciar su papel en el proceso patológico mediante técnicas radiológicas e histológicas. La rinoscopia reveló la destrucción del hueso vómer y una gran masa ocluyendo completamente la cavidad nasal.
Si bien las técnicas de evaluación de la susceptibilidad de los hongos miceliares a los agentes antifúngicos no estaban estandarizadas en ese momento (p.e. CLSI, EUCAST) se pudo realizar también una evaluación de los antifúngicos que podían ser de interés para el tratamiento del caso, mediante una técnica de difusión. La cepa aislada fue sensible a ketoconazol, de sensibilidad intermedia al clotrimazol y resistente a la anfotericina B, 5-fluorocitosina, fluconazol e itraconazol. Aunque los resultados “in vivo” no siempre pueden extrapolarse a partir de los resultados obtenidos “in vitro” en este tipo de pruebas, durante el tratamiento con ketoconazol se observó una mejora general de las lesiones. Después de un mes, la secreción nasal disminuyó y los estornudos desaparecieron. Desgraciadamente, pocos meses después el perro murió atropellado por un coche. Los accidentes de tráfico siguen siendo una causa importante de mortalidad en perros.